3대 재료의 특징 및 구조
세 번째 포스팅입니다. 스테멘토 생각을 계속 계속 하면서 지내다 보니까 앞으로의 연재 방향이나 연재 순서 같은 것들이 점차 머릿속에서 잡혀가는 것 같아요 ㅎㅎ 암튼!! 지난 포스팅에서는 재료공학이란 어떤 분야인지 간략히 알아보았지요?! 이번 포스팅과 다음 포스팅에서는 재료공학에서 주로 다루는 3대 재료! 즉 금속, 세라믹, 폴리머가 각각 어떠한 재료를 일컫는 용어인지 알아보려고 해요. 그래서 각 재료의 정의나 주요 특징을 정리해보고, 그러한 재료들이 어떤 구조를 갖는지 알아볼 거에요. 그럼 시작해보겠습니다.!!
3대 재료의 분류
금속(Metal)
사진 출처
첫 번째 재료는 바로 금속입니다. 금속 재료란 말 그대로 철, 알루미늄, 구리 등 하나 이상의 금속 원소로 구성된 재료를 말하며, 소량의 비금속 원소, 예를 들어 탄소, 질소 등이 첨가되는 경우도 있습니다. 이렇게 금속 원소에 소량의 비금속 원소가 첨가되거나, 두 개 이상의 금속 원소에 의해 구성된 금속 물질을 합금(alloy)이라고 하지요. 전자의 예로는 철에 탄소가 소량 함유된 탄소강, 그리고 후자의 경우에는 Al-Cu 합금이 있겠네요.
금속의 경우 원자들이 매우 규칙적으로 배열되어 있고 세라믹, 고분자에 비해 밀도도 높습니다. 또한 구조용 재료로 금속이 널리 사용되는 것에서 알 수 있듯이, 단단하고(높은 탄성계수) 강하지만(높은 인장 강도) 연성 또한 뛰어나 파괴가 잘 일어나지 않는다는 매우매우 중요한 장점을 가지고 있습니다.
사진 출처
금속의 또 다른 주요 특징은 수많은 자유전자들이 금속 원자들 사이를 떠돈다는 거지요. 흔히 전자바다모형(electron sea model)이라고 설명하는데, 전자들이 금속 원자에 속박되어 있는 게 아니라 지구를 떠도는 바닷물처럼 자유롭게 슉슉 돌아다니고, 이러한 특징 때문에 많은 성질들이 발생하게 된답니다. 그 중 가장 쉽게 이해할 수 있는 것이 바로 높은 전기전도도지요. 전기전도도라는 게 물질이 전하를 운반하는 정도를 뜻하는데, 자유전하가 많으면 전기전도도가 높은 건 당연하겠죠? ㅎㅎ 전기전도도뿐만 아니라, 자유전자들에 의해 열전도도도 뛰어나고, 불투명하고 광택이 나는 등의 특징도 갖게 돼요!! 우리가 금속이라고 하면 왠지 차가울 것만 같은 느낌이 드는 이유가 바로 높은 열전도도 때문이에요. 열전도도가 높은 만큼 우리 손의 열을 쭉쭉 뽑아가고, 우리는 차갑다는 느낌을 느끼게 되는 거지요 ㅎㅎ
마지막으로 잘 알려진 명언 하나를 남기고 다음 내용으로 넘어가도록 하죠.
사진 출처
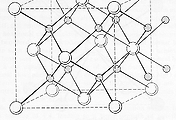
금속의 구조
금속 결합은 특정한 방향성을 가지지 않기 때문에, 금속의 원자들은 일정한 규칙을 가지고 배열되어 있고, 그래서 비교적 간단한 편이에요. 우리는 이렇게 규칙성을 갖는 금속의 결정구조를 나타내기 위해서 unit cell이라는 작은 반복 단위를 설정하는데요. 보통 unit cell은 평행육면체나 각기둥 구조를 갖고, 이러한 unit cell이 계에에에속 반복되어 금속의 결정구조가 이루어진다고 볼 수 있죠.
사진 출처
우리는 unit cell이 어떤 모양인지, 그리고 unit cell 내에 원자가 어떻게 위치해있는지에 따라 결정구조를 구분하는데, 유명한 Bravais 아저씨에 의하면 가능한 3차원의 결정구조는 총 14개라고 해요. 이걸 Bravais lattice라고 하는데, 쪼금 복잡하니 나아아아중에 기회가 되면 따로 다루도록 할게요. ㅎㅎ 왜 나중에 다뤄도 되냐면 사실 대부분의 금속은 FCC, BCC, HCP, 이렇게 세 종류의 간단한 결정구조만을 가지거든요. 그래서 이번 시간에는 세 가지 주요 결정구조에 대해 알아볼 텐데, 우리가 금속의 결정구조를 나타낼 때는 보통 각 금속 이온들을 원자구로 나타낸 원자구 모델을 이용해요.
그리고 추가로 알아둬야 할 개념이 바로 배위수(coordination number)와 원자 충진율(atomic packing factor, APF)에요. 배위수란 금속에서 한 원자 주변에 가장 가까이 위치하는 원자의 수를 뜻하고, 원자 충진율이란 unit cell 내에서 원자구들이 차지하는 부피의 비율을 뜻해요.
사진 출처
우리가 첫 번째로 볼 구조는 바로 FCC입니다.(그림이랑 순서가 달라서 죄송해요 ㅎㅎ) FCC란 Face-Centered Cubic, 우리말로는 면심입방 구조입니다. 면. 심. 말 그대로 정육면체의 unit cell에서 각 면의 중심과 각 꼭짓점에 원자들이 자리 잡은 녀석이죠. 우리가 아는 금속 중에는 구리나 알루미늄 등이 FCC 구조를 갖고 있대요!
그림을 보면, 하나의 unit cell에는 면심에 위치한 6개의 원자, 그리고 꼭짓점에 위치한 8개의 원자가 존재하죠? 그런데 면심에 위치한 하나의 원자는 2개의 unit cell이 공유하고, 꼭짓점에 위치한 한 원자는 주변의 8개의 unit cell이 공유하기 때문에 각각 1개가 아닌 1/2개, 1/8개의 원자가 한 unit cell에 속해있다고 봐야 해요. 그렇게 생각한다면 FCC 구조에서는 면심에 3개, 꼭짓점에 1개의 원자가 있어서 토탈 4개의 원자가 한 unit cell에 들어있다고 볼 수 있겠네요.
배위수는 얼마일까요? 배위수를 따질 때는 아무 원자나 잡고, 가장 가까이 이웃한 원자들을 세면 되는데 우리는 unit cell의 윗면의 중심에 있는 원자를 잡아볼게요. 그럼 일단 윗면의 꼭짓점의 4개 원자들이 가장 가깝게 있고요. 끝인가요? 아니죠. 잘 생각해보면 unit cell의 네 개의 옆면의 중심에 있는 원자들도 같은 거리에 위치해 있어요. 그렇다면 우리가 처음 잡은 원자의 위쪽에 있는 unit cell의 옆면에도 똑같이 4개가 있겠네요. 이렇게 총 12개가 가장 가까이 이웃하고 있고, 그러므로 FCC의 배위수는 12가 됩니다.
원자 충진율의 계산은 직접 하지는 않을 건데, 어렵지 않게 계산해보면 0.74의 값을 얻을 수 있어요. 즉 unit cell 부피의 74%가 원자들로 이루어져있다는 것이죠. 적어보일 수도 있는데, 74%는 실제로 같은 크기의 구들을 쌓는 방법 중에 가장 높은 충진율이라고 해요.
BCC는 Body-Centered Cubic, 우리말로 체심입방 구조에요. BCC는 말 그대로 바디의 센터에, 그러니까 정육면체 형 unit cell의 중심과 각 꼭짓점에 원자들이 위치합니다. unit cell 내 원자의 수를 계산해보면 중심의 원자는 통째로 unit cell에 들어있으니 1개이고, 꼭짓점에는 1/8개의 원자가 8개, 그래서 총 2개가 들어있네요. 배위수는 계산하기가 정말 간단해요. 가운데 있는 원자의 주변에 있는 가장 가까운 원자를 세어보면 당연히 꼭짓점에 있는 원자 8개겠죠? ㅎㅎ 그러니 배위수는 8! 원자 충진율은 0.68로, 0.74의 FCC에 비해 덜 오밀조밀 모여 있다는 걸 알 수 있고, BCC 구조를 갖는 유명한 금속으로는 크롬이나 텅쓰텐이 있어요!
마지막으로 HCP는 Hexagonal Close-Packed로, 육방조밀 구조라고도 부르죠. 얘는 앞의 FCC, BCC와 달리 unit cell이 정육면체가 아니라 육각기둥임을 알 수 있어요. 그래서 이름이 hexagonal이구요. HCP unit cell은 세 개의 층으로 이루어져 있는데, 위와 아래에는 6개의 원자가 6각형의 각 꼭짓점을 이루며 가운데의 원자를 둘러싼 형태이고, 중간층에는 3개의 원자가 위치해있어요. 위아래층의 꼭짓점의 원자들은 각각 6개의 unit cell이 공유하므로 하나당 1/6개이고 면심의 원자는 1/2개, 중간층의 원자들은 통째로 unit cell에 들어있으므로, 한 unit cell에는 꼭짓점에 12개의 1/6 원자, 면에는 2개의 1/2원자, 중간에는 3개의 원자, 이렇게 총 6개 원자가 한 unit cell에 들어 있답니다. 배위수와 원자 충진율은 FCC와 동일한 12개, 0.74를 가지고, HCP 구조의 금속으로는 카드뮴이나 마그네슘, 아연 등이 있다네요~
오늘은 금속까지..
금속에 대한 내용이 길어져서, 세 번째 포스팅은 여기서 마치구 세라믹, 폴리머는 다음 포스팅에서 다루도록 하겠습니다. 다음에 만나요~
'지난 연재물 - 재료공학 > [재료공학] 민시키의 생활 속 재료 이야기' 카테고리의 다른 글
| 재료이야기 #06. 재료공학의 레시피, Phase Diagram(상평형도) (2) (11) | 2015.06.26 |
|---|---|
| 재료이야기 #05. 재료공학의 레시피, Phase Diagram(상평형도) (1) (5) | 2015.06.22 |
| 재료이야기 #04. 금속, 세라믹, 폴리머의 특징 및 구조 (2) (7) | 2015.06.01 |
| 재료이야기 #02. 재료공학을 알아보자 (4) | 2015.05.17 |
| 재료이야기 #01. 첫 이야기 (2) | 2015.05.05 |







댓글