안녕하세요? 저는 공우 14.5기 최장현입니다.
최근 일반 소화기로 불을 끌 수 없어 화제가 되어 뉴스에 자주 나오는 전기차! 이 전기차에서 화재를 일으키는 원인은 2차전지 즉, 배터리입니다. 배터리에 대한 전반적인 내용이 궁금하시다면 이 글을 읽어보시는 걸 추천합니다.
1. 과목에서 배울 수 있는 내용
1.1. 전반적인 내용
: 최근에는 전기차에 대한 수요가 조금 줄어들고 있는 추세이지만 2023년 전기차에 대한 관심은 정말 뜨거웠습니다. 이러한 관심에 힘입어 전기차와 관련된 기술들에 대한 주목도도 더불어 상승했습니다. 그 중 가장 핫했던 분야는 바로 충전과 방전이 가능한 배터리(이차 전지)였습니다! 이러한 리튬 이온 배터리와 그 기본이 되는 전기화학에 대해 배우는 것이 본 과목의 핵심입니다. 또한 그린 수소 생성과 관련된 내용들도 다루어 본 과목에서는 크게 다음과 같은 내용들을 배우게 됩니다.
1) 전기화학의 기본 지식
2) 다양한 리튬 이온 배터리(Cathode)
3) 리튬 이온 배터리의 음극(Anode)
4) 리튬 이온 배터리 재활용
5) 리튬 이온 배터리 전해질 및 첨가제
6) 그린수소 생성
1)에서는 리튬 이온 배터리를 해석하기 위해 알아야 할 기본적인 전기화학의 개념에 대해서 배우게 됩니다. 이후 2)부터 본격적으로 리튬 이온 배터리에 대해서 배우게 됩니다. 먼저 cathode를 중심으로 크게 LCO, LMO, LFP를 다루게 됩니다. 3)에서는 배터리를 구성하는 음극(anode)에 대해 배우는데, 이 때 탄소로 만들어진 음극에 대해 먼저 배우고 그 문제점을 해결하기 위한 다른 기술들을 알게 됩니다. 4)를 통해서는 배터리의 핵심이 되는 리튬이 재활용될 수 있는 방법들을 배우고 5)에서는 배터리 성능 향상에 도움이 되는 전해질과 첨가제에 대해 배웁니다. 마지막으로 6)에서는 배터리는 아니지만 앞으로 화석연료 사용량을 줄이기 위한 기술로 주목받고 있는 수소에 대한 수업이 진행됩니다. 이를 통해 수소를 생산하는 다양한 방식 중에서 전기화학을 활용한 가장 친환경적인 방법에 대해 알 수 있습니다.
1.2. 전기화학의 기본 지식
: 배터리는 기본적으로 전극(electrode), 전해질(electrolyte), 첨가제(additive)로 구성되며 해당 요소들 사이로 전자가 사이클을 따라 움직이면서 구동하게 됩니다. 따라서 본격적으로 배터리를 다루기 위해서는 각 요소와 요소들 사이의 반응이 어떻게 일어나는지에 대해 배워야 합니다. Figure 1은 가장 기본적인 electrochemical cell을 나타낸 것입니다. 양쪽에 있는 것이 전극이고 전극 사이를 구성하는 부분이 전해질입니다. 이 때 주의해야할 점은 전극을 연결하는 전선을 따라서는 전자가 직접 움직여야 하고, 전해질을 이동할 때는 직접 이동하는 것이 아니라 전해질을 구성하는 이온들의 움직임에 의해 간접적으로 움직여야 합니다. 따라서 전극은 electronic conductor인 반면에 전해질은 ionic conductor입니다. 하지만 결국 전자가 전극과 전해질 사이를 이동해야 하기 때문에 각 전극에서는 산화(oxidation)과 환원(reduction) 반응이 일어나게 됩니다. Oxidation은 전극에서 전자가 나와 전해질이 받는 경우를 의미하고 이러한 전극을 anode라고 부릅니다. 반대로 reduction은 전해질의 전자를 전극이 받는 현상이고 해당 전극은 cathode라고 부릅니다.

[Figure 1] Electrochemical cell
그렇다면 전자가 움직일 수 있도록 해주는 원동력은 무엇일까요? 전기화학에서는 이를 voltage라고 부릅니다. 전압은 일종의 전기적 위치에너지인potential의 차이를 의미합니다. 따라서 전극과 전해질의 potential 차이에 의해서 전자의 이동방향이 결정되게 됩니다. 해당 방향대로 반응을 일으킨다면, 반응이 자발적이기 때문에 cell에는 다른 조치를 취해줄 필요가 없고 전자가 자연스럽게 움직이며 전기에너지로 사용될 수 있게 됩니다. 하지만 비자발적인 방향으로 전자를 이동시키고 싶다면 반응의 equilibrium potential보다 많은 cell potential을 가해주어야 합니다. 그 차이를 overpotential이라고 부릅니다. 따라서 overpotential은 반응이 일어나기 어려운 정도를 가리키는 척도로 사용될 수 있습니다.
앞서 이야기한 것 같이 cell에서는 전자가 이동하면서 전기에너지가 발생되거나 사용되게 됩니다. 여기서 배터리의 성능을 파악하기 위해서 알아야 할 개념이 바로 일정 시간 동안 이동하는 전자의 양입니다. 같은 voltage를 걸어주었을 때 더 많은 전자가 이동한다면 이는 사용할 수 있는 전기 에너지가 늘어남을 의미합니다. 이런 일정 시간동안 움직이는 전자의 흐름을 current라고 부릅니다.
전공백서에서 모든 내용을 다룰 순 없기 때문에 본 글에서는 후속 설명을 위한 기본적인 지식들만 작성했고 이외에도 voltage를 측정하는 방법이나 전기화학 반응의 kinetics들을 더 자세하게 배우게 됩니다.
1.3. 다양한 리튬 이온 배터리
: 본격적으로 배터리를 다루기 전에 용어정리를 제대로 할 필요가 있습니다. 왜냐하면 배터리는 충전과 방전을 할 때 전극을 부르는 명칭이 바뀌기 때문입니다. 배터리를 방전한다는 것은 외부의 힘 없이 자발적인 반응을 바탕으로 사용한다는 것을 의미합니다. 따라서 방전에 적용되는 화학반응은 자발적인 반응에 의해 전해질로부터 전자를 얻는 anode로부터 전선을 따라 cathode로 전자가 이동합니다. 반대로 충전 시에는 각 전극에서 방전 시 일어났던 화학반응의 역반응이 일어나야 합니다. 따라서 비자발적 반응이기 때문에 voltage가 필요한 것은 물론이고 역반응이 일어나기 때문에 방전시, anode였던 전극은 cathode가 되고 cathode였던 전극은 anode가 됩니다. 이로 인해 용어의 혼선이 생길 수 있기 때문에 배터리는 각 전극을 방전 기준으로 cathode와 anode로 부르게 됩니다. 그리고 흔히 양극(positive electrode)이 cathode를 지칭하고 음극(negative electrode)이 anode를 의미합니다.
리튬 이온 배터리의 성능을 비교하기 위해서는 크게 두가지 요소를 확인합니다. 하나는 reaction potential이고 다른 하나는 capacity입니다. Reaction potential은 자발적인 반응이 일어날 때 발생하는 potential을 의미합니다. Cathode에서 발생하는 화학반응이 anode에서 발생하는 화학반응과 비교했을 때 일정 이상의 potential 차이가 존재해야 충분한 전자가 이동해 전기에너지로 사용될 수 있습니다. Reaction potential이 전선을 따라 움직이는 전자의 이동을 결정하기 때문에 중요한 요소라면 capacity는 electrolyte에서 이온이 움직이는 것을 결정하기 때문에 중요한 요소입니다. 1.2에서 언급한 것과 같이 cell이 구동하기 위해서는 ionic conductor인 electrolyte에서 이온이 잘 움직여야 합니다. 따라서 전극이 수용할 수 있는 이온의 양, 즉 리튬 이온 배터리에서는 주로 리튬 이온의 양이 중요한 요소이고 이를 capacity로 표현합니다. Capacity의 경우 음극에 비해 양극이 적은 경우가 대다수라 양극의 capacity를 주로 지칭하게 됩니다.
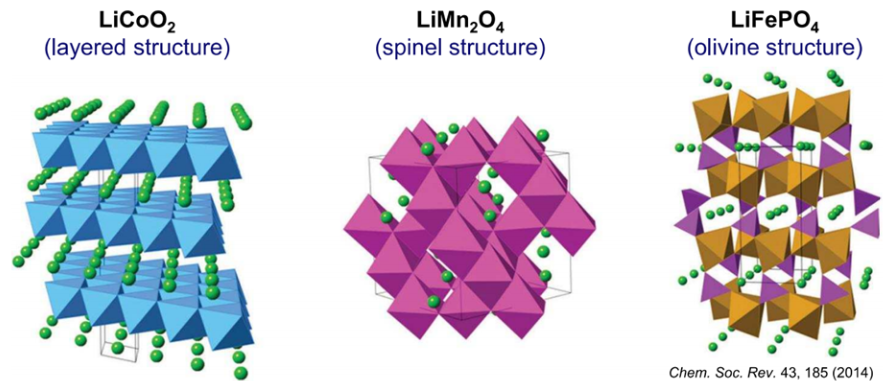
[Figure 2] Cathode structure of LCO, LMO and LFP
1.4. 리튬 이온 배터리의 음극
: 1.3에서는 리튬 이온 배터리의 cathode에 대해서 주로 다루고 이를 바탕으로 비교를 진행하는 것을 배웠다면 그 이후에는 반대편의 전극인 anode를 구성하는 요소와 이에 따른 성능 변화를 배우게 됩니다. 현재 리튬 이온 배터리의 anode로 가장 많이 사용되는 것은 탄소입니다. 탄소는 리튬 이온과 비교했을 때 주변에서 훨씬 구하기 쉽다는 장점이 있습니다. 하지만 electrolyte에서 리튬 이온이 탄소 층 사이로 움직이는 intercalation이 발생하게 되면 전극 주변에 Solid Electrolyte Interphase (SEI)가 생깁니다. SEI층은 전해질과 전극이 직접적으로 접촉하는 것을 막아 이온의 이동을 방해하기 때문에 해당 문제를 해결할 수 있어야 합니다.
또 다른 쟁점은 자연에서 만들어진 natural carbon을 이용할 것인지 인공적으로 만든 artificial carbon을 이용할 것인지에 있습니다. Carbon은 크게 basal plane과 edge plane으로 구성되어 있는데 intercalation은 주로 edge plane을 통해서 이루어지게 됩니다. 자연적으로 생성된 natural carbon은 crystallization이 충분히 일어나 basal plane이 크고 상대적으로 edge plane이 작습니다. 이런 단점을 개선하기 위해 artificial carbon을 사용하는 방법이 시행되었고 이는 배터리가 한번에 많은 양의 전자를 이동할 수 있게 해주어 출력을 높여주는 결과로 이어졌습니다. 이처럼 carbon은 리튬에 비해 구하기도 쉽고 가격도 싸고 출력도 높일 수 있지만 다른 음극재에 비해 capacity가 낮다는 단점이 존재합니다. 따라서 이를 해결하기 위해 Insertion(Intercalation), Alloying, Conversion이라는 3가지 방법도 배우게 됩니다. 해당 글에서는 각 방법을 자세히 다루지는 않겠지만 Figure 3을 참고한다면 간단하게 이를 확인할 수 있고 더 자세한 내용은 수업에서 배우실 수 있습니다.
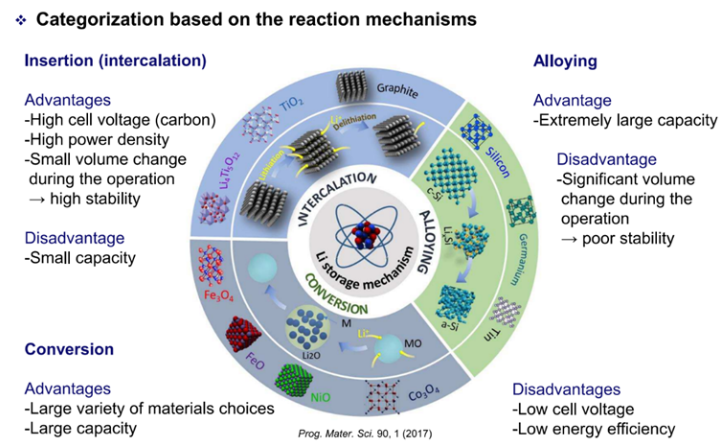
[Figure 3] Method that can deal with low capacity of carbon
1.5. 리튬 이온 배터리의 재활용
: 리튬 이온 배터리의 성능을 제외한 가장 큰 문제점은 리튬의 희소성입니다. 리튬은 전세계에 골고루 분포되어 있지 않고 주로 칠레와 중국에 분포되어 있습니다. 이런 특성을 이용해 특히 중국은 리튬의 수출을 억제해 자원을 무기화하고 있습니다. 이에 대응할 수 있는 방법 중 하나가 이미 사용된 배터리에서 리튬을 추출해서 재활용하는 것입니다. 현재는 전해질로부터 리튬 이온을 추출하는 방법이 연구되고 있습니다. 이 때 주의해야할 점은 전해질에 있는 다른 금속 이온인 마그네슘, 포타슘, 칼슘, 칼륨 이온은 추출하지 않고 리튬만 추출해야 한다는 것입니다. 이를 위해서 사용하는 기본 원리는 Figure 4를 통해 확인할 수 있듯이 다른 금속 이온에 비해 크기가 작은 리튬 이온의 특성을 이용하는 것입니다. 리튬 이온은 0.90Å, 포타슘 이온은 1.16Å, 칼륨 이온은 1.52Å, 마그네슘 이온은 0.86Å, 칼슘 이온은 1.14Å이기에 마그네슘 이온을 제외하고는 크기 차이로 리튬 이온을 분리할 수 있습니다. 마그네슘 이온의 경우 리튬 이온보다 크기가 작지만 이온 상태에서 전하가 크기 때문에 이를 활용하여 분리를 진행한다고 배웁니다.
1.6. 리튬 이온 배터리 전해질 및 첨가제
: 해당 파트에서는 전극 외에 cell을 구성하는 요소들인 전해질과 첨가제에 대해 배우게 됩니다. 전체 cell이 잘 구동하기 위해서는 전해질에서 이온들이 잘 움직일 수 있어야 합니다. 따라서 전해질은 상대적으로 유전율이 높은 물질들로 구성되는 것이 유리합니다. 대표적으로 Ethylene carbonate(EC)와 Propylene carbonate(PC)가 주로 solvent로 사용됩니다. 이와 같은 ionic conductivity 외 전해질의 중요한 요소는 1.3에서 언급한 capacity와 관련이 있는 리튬 이온의 양입니다. 리튬 이온이 많아야 intercalation이 더 잘 일어날 수 있고 이를 통해 cell의 구동도 더 원활해집니다. 따라서 용해되었을 때 리튬 이온이 전해질로 잘 나오는 육불화인산리튬이 주로 사용됩니다. 그 이유는 육불화인산리튬의 양이온인 리튬 이온과 음이온인 육불화인산이온의 크기 차이가 많이 나기 때문에 분리가 용이해 리튬 이온이 많이 발생하기 때문입니다. 하지만 육불화인산리튬은 물과 만나게 되면 플루오린화 수소를 생성시키고 이는 유독한 물질로 전극의 구조를 파괴할 수 있습니다. 이런 파괴에 대한 대안이 vinylene carbonate(VC)나 fluoroethylene carbonate(FEC)와 같은 첨가제를 사용하는 것입니다.
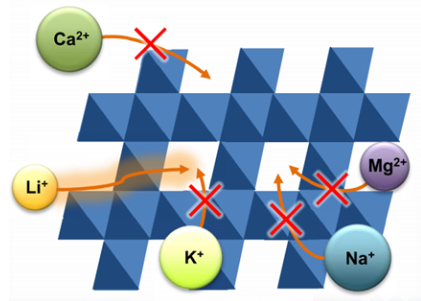
[Figure 4] Principle of Li ion battery recycle
1.7. 그린 수소 생성
: 신에너지를 구성하고 있는 수소 에너지는 다양한 방법으로 생성될 수 있습니다. 현재 가장 많이 사용되고 있는 방법은 화석연료를 태우는 것입니다. 이는 친환경적이지 못한 방법으로 그레이 수소라고 불립니다. 이런 단점을 해결하기 위해 물을 전기분해하여 수소를 얻는데 이 때 얻는 수소를 그린 수소라고 부릅니다. 강의에서는 그린 수소를 만드는 기본적인 매커니즘인 수소 발생 반응(HER, Hydrogen Evolution Reaction)과 산소 발생 반응(OER, Oxygen Evolution Reaction)부터 배우기 시작합니다. 해당 반응들은 자발적인 반응이 아니기 때문에 반응을 더 쉽게 할 수 있도록 만들어주는 촉매의 역할이 매우 중요합니다. 수업에서는 해당 촉매를 만들기 위해 기반이 되는 Sabatier principle을 배우고 이를 바탕으로 volcano plot을 해석하는 방법에 대해 배웁니다. 이외에도 실제로 성능이 더 좋은 촉매를 만들기 위한 기법들과 해당 기법들이 작동되는 원리에 대해서 배우며 수업이 마무리됩니다.
앞서 배운 배터리는 전체적인 bulk를 바탕으로 반응이 진행된다면 그린 수소의 경우에는 촉매의 표면에서의 반응을 주로 다루고 있습니다. 따라서 같은 전기화학이지만 다른 분야를 배워볼 수 있는 기회가 될 수 있습니다.
2. 선배의 조언
: 에너지자원공학과만 전공하는 학생이라면 전기 시스템에 대해 처음 배우는 강의이기 때문에 따로 선수강해야 하는 과목은 없습니다. 교수님께서도 이 부분을 알고 계셔서 바로 배터리와 그린 수소같이 시스템을 설명하시는 것이 아니라 전기화학의 기본을 열심히 설명하십니다. 그래서 전기화학 분야를 처음 접하는 저도 수업을 잘 수강할 수 있었기 때문에 전기화학을 아예 모른다고 해서 수업을 듣는데 부담을 가지실 필요는 없을 것 같습니다.
다만 수업이 영어로 진행되어 걱정하실 수 있습니다. 하지만 교수님께서 수업 중간에도 질문할 수 있는 시간을 주시고 강의를 시작하기 전에는 이전 강의를 짧게 요약해주시기 때문에 수강하는데 큰 어려움은 없었습니다. 하지만 ppt가 figure 위주로 구성되어 있어서 수업을 듣지 않는다면 따라가는데 어려움이 있을 수 있습니다. 따라서 수업을 듣고 필기해두는 것을 추천합니다. 해당 과목은 특히 연습문제나 과제가 따로 없고 교수님께서 설명하시는 것 위주로 수업과 시험이 구성되기 때문에 스스로 필기하고 복습하지 않으면 조금 어려움이 있을 수 있다고 생각합니다. 초반 전기화학의 기본 파트가 새로운 개념이 많이 등장해 헷갈리실 수 있지만 한 번 정리를 잘 해두면 이 후 수업을 수강하는데 도움이 많이 될 거라고 생각합니다.
3. 진로 선택에 도움되는 점
: 본 과목은 에너지자원공학과에서 거의 유일하게 전기화학을 다루고 있는 수업입니다. 특히 관심이 많이 집중되고 있는 배터리에 대해서 배워보는 것을 희망한다면 해당 과목을 듣는 것을 추천합니다. 저도 역시 이 분야에 흥미가 있어서 해당 수업을 선택하게 되었고 수업을 들은 후에 해당 분야의 대학원으로 진로를 결정하게 되었습니다.
4. 맺음말
: 본 과목은 전기화학을 가장 잘 접할 수 있는 에너지자원공학과 수업이라고 생각합니다. 특히 이론적인 부분에 많이 치중한 수업이 아니라 기본적인 개념을 바탕으로 실생활과 밀접한 배터리와 수소에너지에 대해 배워볼 수 있다는 점이 흥미로웠습니다. 여러분들도 즐겁게 수강하시기를 기원합니다!

'전공백서 > 에너지자원공학과' 카테고리의 다른 글
| 에너지자원공학과: 저류층 지오메카닉스 (5) | 2024.08.28 |
|---|---|
| 에너지자원공학과: 신재생에너지 (0) | 2024.07.01 |
| 에너지자원공학과: 에너지와 기후변화 (2) | 2024.06.30 |
| 에너지자원공학과: 국제에너지시장분석 (0) | 2024.06.26 |
| 에너지자원공학과: 탄성파탐사 (0) | 2024.06.25 |





댓글